La principal diferencia entre órbita y orbital radica en su ámbito de aplicación: una órbita describe la trayectoria curva de un objeto alrededor de otro en el espacio, mientras que un orbital se refiere a la región en un átomo donde es probable encontrar un electrón según la mecánica cuántica.
En el ámbito de la física y la química, los términos órbita y orbital son frecuentemente utilizados, pero a menudo se confunden debido a sus similitudes lingüísticas y a su relación con los electrones y los átomos. Sin embargo, estos conceptos difieren significativamente en su significado y aplicación. Este artículo se enfoca en desglosar y explicar la diferencia entre órbita y orbital de manera detallada y precisa.
Tabla de contenidos
ToggleDefinición de Órbita

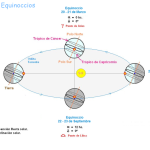
La órbita se refiere a la trayectoria curva que un objeto, como un planeta o un satélite, sigue alrededor de otro objeto debido a la fuerza gravitacional. En el contexto de los electrones y los átomos, una órbita describe el camino fijo y circular que un electrón sigue alrededor del núcleo del átomo, según el modelo de Bohr. Este modelo, aunque fundamental en la comprensión inicial de la estructura atómica, es una representación simplificada y no refleja con precisión la realidad cuántica.
Características de la Órbita
Las órbitas son generalmente elípticas, aunque pueden ser circulares en casos específicos. La teoría de Bohr postula que los electrones se mueven en órbitas a distancias definidas del núcleo, y cada órbita corresponde a un nivel de energía específico. Esta teoría fue revolucionaria para su época, pero ha sido superada por modelos más complejos y precisos.
Definición de Orbital
El término orbital se refiere a una región tridimensional en el espacio alrededor del núcleo del átomo donde existe una alta probabilidad de encontrar un electrón. Esta definición surge del modelo mecánico-cuántico del átomo, que utiliza funciones de onda para describir la probabilidad de la ubicación de un electrón.
Características del Orbital
Los orbitales tienen formas y orientaciones diversas, que se determinan por los números cuánticos asociados a cada electrón. Existen diferentes tipos de orbitales, como los s, p, d y f, cada uno con su configuración espacial única. A diferencia de las órbitas, los orbitales no describen trayectorias fijas sino áreas de probabilidad.
Comparación entre Órbita y Orbital
La principal diferencia entre órbita y orbital radica en su conceptualización y en el modelo atómico que representan. Mientras que la órbita es un concepto clásico asociado con trayectorias fijas, el orbital es un concepto cuántico que describe regiones de probabilidad.
Modelo Clásico vs. Modelo Cuántico
El modelo de Bohr, que utiliza órbitas, es un modelo clásico que simplifica la comprensión del átomo mediante trayectorias definidas. Por otro lado, el modelo mecánico-cuántico, que introduce el concepto de orbitales, ofrece una descripción más realista y precisa del comportamiento de los electrones, basándose en principios de la mecánica cuántica y funciones de onda.
Visualización y Representación
Las órbitas se visualizan como círculos o elipses alrededor del núcleo, mientras que los orbitales se representan como nubes de probabilidad con formas variadas, como esferas, lóbulos y anillos. Esta diferencia en la visualización refleja la naturaleza más abstracta y probabilística de los orbitales en comparación con las órbitas.