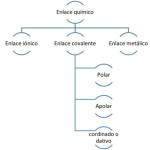
Enlace covalente polar y no polar es un término usado para describir la forma en que los átomos se unen para formar moléculas. Estos enlaces se forman cuando los electrones de los átomos se comparten entre dos átomos. Esto puede resultar en un enlace covalente polar o no polar. Ambos enlaces tienen sus propias características que los distinguen entre sí.
Tabla de contenidos
Toggle¿Qué es el enlace covalente polar?

El enlace covalente polar se produce cuando los átomos comparten electrones de manera desigual. Esto significa que uno de los átomos atrae los electrones con más fuerza que el otro, creando una ligera desigualdad en la distribución de carga. Esto hace que el enlace sea parcialmente positivo en un lado y parcialmente negativo en el otro.
Ejemplos de enlaces covalentes polares
Algunos ejemplos de enlaces covalentes polares son el agua, el amoníaco y el ácido clorhídrico. Estas moléculas tienen un lado positivo y un lado negativo, lo que les permite atraerse entre sí. Esta propiedad se conoce como polaridad.
¿Qué es el enlace covalente no polar?
Un enlace covalente no polar se produce cuando los átomos comparten los electrones de manera equitativa. Esto significa que los electrones se distribuyen de manera uniforme entre los dos átomos, lo que hace que el enlace sea neutral en lugar de parcialmente positivo o parcialmente negativo.
Ejemplos de enlaces covalentes no polares
Algunos ejemplos de enlaces covalentes no polares son el dióxido de carbono, el hexano y el etano. Estas moléculas no tienen un lado positivo o negativo, sino que son completamente neutras.
Diferencias entre enlace covalente polar y no polar
Las principales diferencias entre un enlace covalente polar y no polar son las siguientes:
- Distribución de carga: el enlace covalente polar tiene una desigualdad en la distribución de carga, mientras que el enlace covalente no polar es neutral.
- Polaridad: el enlace covalente polar tiene polaridad, mientras que el enlace covalente no polar no tiene polaridad.
- Ejemplos: el agua, el amoníaco y el ácido clorhídrico son ejemplos de enlaces covalentes polares, mientras que el dióxido de carbono, el hexano y el etano son ejemplos de enlaces covalentes no polares.
Para obtener más información sobre la diferencia entre enlace covalente polar y no polar, puede consultar nuestra sección de Preguntas frecuentes.
Preguntas frecuentes
¿Qué es un enlace covalente?
Un enlace covalente es una fuerza de atracción entre átomos que comparten electrones. Compartir electrones es la forma en que los átomos se unen para formar moléculas.
¿Cuál es la diferencia entre enlace covalente polar y no polar?
Un enlace covalente polar se produce cuando los átomos comparten electrones de forma desigual, de forma que la carga eléctrica se distribuye de forma no uniforme. Esto significa que uno de los átomos tendrá una carga parcial positiva, mientras que el otro tendrá una carga parcial negativa. Un enlace covalente no polar se produce cuando los átomos comparten los electrones de forma igual, de forma que la carga eléctrica se distribuye de forma uniforme. Desigualdad de carga y igualdad de carga son las principales diferencias entre enlaces covalentes polares y no polares.
¿Qué significa polaridad?
La polaridad es una distribución desigual de carga eléctrica en una molécula. Esto significa que una molécula polar tendrá una carga parcial positiva en un extremo y una carga parcial negativa en el otro extremo. Carga desigual es la característica de la polaridad.
¿Qué es una molécula polar?
Una molécula polar es una molécula cuyos átomos están unidos mediante enlaces covalentes polares. Estas moléculas tienen una carga parcial positiva en un extremo y una carga parcial negativa en el otro. Enlace covalente polar es la característica de una molécula polar.
¿Cómo se forman enlaces covalentes polares?
Los enlaces covalentes polares se forman cuando los átomos comparten electrones de forma desigual. Esto significa que uno de los átomos tendrá una mayor afinidad por los electrones compartidos, lo que resulta en una carga parcial positiva. El otro átomo tendrá una menor afinidad por los electrones compartidos, lo que resulta en una carga parcial negativa. Compartir electrones desigualmente es la forma en que se forman los enlaces covalentes polares.
¿Cómo se forman enlaces covalentes no polares?
Los enlaces covalentes no polares se forman cuando los átomos comparten electrones de forma igual. Esto significa que los átomos comparten los electrones de forma uniforme, lo que resulta en una carga eléctrica distribuida de forma uniforme. Compartir electrones igualmente es la forma en que se forman los enlaces covalentes no polares.